In den Schwerpunkten der Audits der Überwachungsbehörden spiegeln sich die aktuellen Diskussionsthemen der nationalen und internationalen Gesetzgeber zur Interpretation und Umsetzung der «Regeln der guten Herstellpraxis»-GMP (Good Manufacturing Practice) wider. Dabei zeigt die Auswertung der Findings der FDA (Food and Drug Administration) des vergangenen Jahres, dass ein wesentlicher Schwerpunkt der identifizierten Mängel in der Prozessvalidierung liegt. Die FDA kritisiert aber auch immer wieder grundlegende Schwächen in der Qualifizierung der Produktionseinrichtungen, sprich Anlagenqualifizierung.
GxP-Blog
Herausforderungen der Anlagenqualifizierung
Die Anforderungen, die an eine adäquate Qualifizierung von Räumlichkeiten, Systemen und Ausrüstungen gestellt werden, wie sie der GMP-Guide Annex 15 seit vielen Jahren unverändert fordert, haben sich in den vergangenen Jahren weiterentwickelt. Während noch vor zehn Jahren verfahrens- und anlagentechnische Fragestellungen im Fokus der «klassischen» Anlagenqualifizierung standen, spielt heute die Forderung nach einem «ganzheitlichen» Prozesswissen-basierten und risikobewerteten Ansatz die zentrale Rolle (vgl. Intenational Society for Pharmaceutical Engineering (ISPE) Good Practice Guide «Applied Risk Management for Commissioning and Qualification», ASTM International Standard E2500). Bereits bei der Qualifizierung der Anlagen müssen die Produkt- und Prozessanforderungen bekannt sein und ausreichend berücksichtigt werden. Der Nachweis der Eignung des jeweiligen Systems für den zukünftigen Einsatz («Suitability for Intended Use») muss erbracht werden. Die FDA-Guideline zur Prozessvalidierung führt dazu aus, dass eine Anlagenqualifizierung ohne Verständnis des eigentlichen Herstellprozesses keine ausreichende Qualität sicherstellen kann. Der Herstellprozess bekommt damit bereits während der Qualifizierung der Produktionseinrichtungen eine wichtigere Rolle. Standardisierte Qualifizierungsdokumente, die nicht Risiko- und Prozesswissens-basiert erstellt wurden, die also nicht erkennen lassen, dass der zukünftige Herstellprozess berücksichtigt wurde, werden nicht länger genügen, die Eignung der Anlage zu belegen.
Wie kann die prinzipielle Eignung eines Systems für den zukünftigen Einsatzzweck nachgewiesen werden?
Ein Blick in die Regelwerke und deren Interpretationen zeigt, dass Produkt- und Prozessanforderungen wissenschaftlich fundiert verstanden sein müssen, um auf dieser Grundlage risikobasierte Kontrollen und Qualifizierungstests definieren zu können, welche die Eignung des Systems und damit letztendlich auch die Patientensicherheit sicherstellen. Die Eignung muss über den gesamten Lebenszyklus einer Anlage nachgewiesen werden. Die fortwährende Qualifizierung einer Anlage endet nicht nach der PQ, sondern macht eine Fortschreibung der Risikoanalyse und sich wiederholende Requalifizierungen notwendig. Sollten sich neue wissenschaftliche Erkenntnisse über den Prozess oder die Produkterfordernisse ergeben, müssen diese natürlich bei einer Revision der Risikoanalyse und den sich daraus ergebenden Qualifizierungstests berücksichtigt werden. Im Behördenaudit identifizierte Mängel bei der Anlagenqualifizierung, die auf fehlendes Prozessverständnis bzw. Ignorieren der Produktanforderungen zurückzuführen waren, sind die wesentlichen Treiber für die Weiterentwicklung der Anforderungen an die Anlagenqualifizierung.
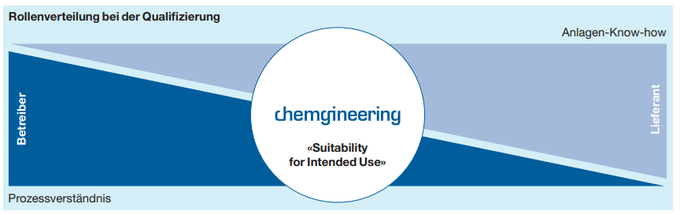
Die Rollenverteilung
Dieser Paradigmenwechsel hat in den vergangenen Jahren sowohl unter den Anlagenlieferanten als auch unter den pharmazeutischen Herstellern für eine veränderte Rollenverteilung gesorgt. Während das technische Know-how (Mechanik und Automation) der Anlagenlieferanten früher ausreichte, um die Anlagenqualifizierung bis zur OQ weitestgehend ohne intensive Einbindung des späteren Betreibers zu ermöglichen, ist heute eine sehr viel engere Absprache und Zusammenarbeit zwischen beiden Parteien notwendig. Viele Lieferanten der pharmazeutischen Industrie bieten standardisierte Qualifizierungspakete, die alle mechanischen und steuerungstechnischen Aspekte der Anlagen berücksichtigen. Auch wenn diese Standarddokumente häufig risikobasiert erstellt werden, können sie ohne Berücksichtigung und Kenntnis der kundenspezifischen Produkt- und Prozessanforderungen den aktuellen behördlichen Anforderungen an die Qualifizierung nicht länger entsprechen.
Der Anlagenlieferant benötigt mehr Produkt- und Prozesswissen und gleichzeitig muss sich der zukünftige Betreiber bereits vor dem Start der Qualifizierung sehr viel intensiver mit den technischen Details seiner Systeme auseinandersetzen. Der Engineeringpartner, der sowohl die Prozess- und Produktanforderungen kennt als auch die technische Expertise zu den Prozessanlagen mitbringt, nimmt dabei eine zentrale Rolle ein. Er übernimmt an den Schnittstellen die Kommunikation und stellt sicher, dass die Anforderungen an die Qualifizierung durchgehend erfüllt werden (siehe Abb. 1).
Abb. 1: Zusammenspiel zwischen Lieferant, Planer und Betreiber
Effiziente Qualifizierungsstrategien
Unsere Erfahrungen zeigen, dass über Erfolg oder Misserfolg eines Qualifizierungsprojektes häufig an den Schnittstellen zwischen Planer, Auftraggeber und Lieferanten entschieden wird. Die jeweilige Projektorganisation muss zur Komplexität des Qualifizierungsprojektes passen. Der Qualifizierungskoordinator übernimmt dabei eine zentrale Rolle im Rahmen komplexer Projekte. Er koordiniert die beteiligten Parteien und stellt neben dem Informationsaustausch auch die Einhaltung der Termine sicher. Der Qualifizierungsablauf für Teilanlagen, Package-Units, Analysensysteme Reinräume und alle anderen Systeme muss frühzeitig definiert werden. Dabei ist es wichtig, die Grenze zwischen Inbetriebnahme-Prüfungen (Good Engineering Practice [GEP]) und GMP-relevanten Qualifizierungsprüfungen zu definieren. Wenn bei Projektbeginn den beteiligten Lieferanten die Qualifizierungsstrategie erläutert wird oder wenn die Lieferanten sogar Einfluss auf diese haben, dann kann eine hohe Effizienz erreicht werden. Qualifizierungsrelevante Tests können bereits beim Lieferanten im Rahmen von Factory Acceptance Tests (FAT) durchgeführt werden. Wenn der Lieferant die Qualitätsanforderungen des Kunden kennt und vorgegebene Akzeptanzkriterien einhält, entfallen zeitaufwendige Wiederholungsprüfungen am Standort des zukünftigen Betreibers. Die Qualifizierung kann zügiger abgeschlossen und die Produktion schneller gestartet werden. Die beteiligten Partner müssen dazu ihre Rolle kennen. Häufig können bestimmte Funktionen nur im Zusammenspiel über Liefergrenzen unterschiedlicher Einheiten hinweg getestet werden. An diesen Schnittstellen entsteht weiterer Koordinationsbedarf. So kann z.B. die Funktion einer CIP-Anlage (Cleaning in Place) erst qualifiziert werden, wenn die Installation und Inbetriebnahme der zu reinigenden Systeme und der zuführenden Mediensysteme abgeschlossen und das übergeordnete Prozessleitsystem installiert ist.
Ein weiterer wesentlicher Baustein einer effizienten Qualifizierungsstrategie ist das Change Management. Der Umgang mit Änderungen und der damit verbundene administrative Aufwand bindet Ressourcen. Diese stehen für andere Aufgaben nicht mehr zur Verfügung, was zu Projektverzögerungen führen kann. Die beteiligten Abteilungen (Qualitätssicherung, Produktion und Qualifizierungskoordination) müssen bei Projektstart den Umgang mit Änderungen definieren.
Effiziente Qualifizierungsstrategien erfordern eine passende Projektorganisation, die Chemgineering auf die jeweiligen Kundenanforderungen zuschneidet. Wir kommen dabei den Anforderungen sowohl global agierender Pharmafimen als auch pharmazeutischer Mittelstandsunternehmen nach.
Chemgineering-Qualifizierungsexpertise
Chemgineering verfolgt die regulatorischen Trends und begleitet seine Kunden im komplexen regulatorischen Umfeld seit mehr als 15 Jahren sehr erfolgreich. In dieser Zeit konnten wir für unsere Kunden mehr als 800000 Stunden Qualifizierungsdienstleistungen erbringen. Seit einigen Jahren beobachten wir einen starken Anstieg der Nachfrage nach praxiserprobtem Qualifizierungssupport. Von der Einbindung unserer Fachingenieure in den Projektablauf können unsere Kunden neben fundiertem GMP-Compliance-Know-how auch solide Kenntnisse der Herstellprozesse und der Produktanforderungen erwarten. Die von uns für unsere Kunden entwickelten effizienten Qualifizierungsstrategien finden dabei Anwendung im Bereich der Wirkstoffproduktion, aber auch in der Arzneimittelproduktion (steril, fest, halbfest) sowie in der Medizintechnik. Derzeit koordiniert Chemgineering umfangreiche Qualifizierungsprojekte in Deutschland, Österreich und der Schweiz.
Diese Seite verwendet Cookies, um Ihnen das bestmögliche Erlebnis zu gewährleisten. Surfen Sie weiterhin auf unserer Seite, stimmen Sie unserer Cookie-Nutzung und unserer Datenschutzrichtlinie zu.