Der Transfer von Analysemethoden ist ein viel diskutiertes Thema und in vielen GMP-Laboren gängige Praxis. Vor dem Transfer einer Methode ist die Entwicklung und Validierung der geeigneten analytischen Methoden ein kritischer Teil des gesamten Lebenszyklus der Arzneimittelentwicklung. Die Durchführung des Transferprozesses muss sorgfältig geplant werden, wobei eine vollständige Bewertung aller Aspekte der Methodenhistorie (einschließlich der ursprünglichen Entwicklung und Validierung) sowie alle bereits bekannten Schwierigkeiten und Probleme berücksichtigt werden muss. In diesem Blog-Artikel gehe ich auf die erforderlichen Schlüsselkomponenten eines Methodentransfers zwischen zwei Laboratorien ein und zeige auf, wie ein erfolgreicher Methodentransfer durchgeführt werden kann.
GxP-Blog
Transfer analytischer Methoden zwischen zwei Laboratorien: Was muss gründlich überprüft werden?
Bei jedem Technologietransfer (Prozess) zwischen zwei Laboratorien gibt es zwei Hauptbeteiligte: das "Transferring Laboratory" (TL) und das "Receiving Laboratory" (RL). Das Transferring Laboratory ist die Quelle oder das Ursprungslaboratorium des analytischen Verfahrens, das RL entsprechend der Empfänger.
Gemäß der USP <1224> ist der Transfer einer Analysemethode definiert als der dokumentierte Prozess, der ein Labor (RL) qualifiziert, eine Analysemethode zu verwenden, die aus einem anderen Labor (TL) stammt, unabhängig davon, ob es sich um ein internes oder externes Labor handelt.
Zur Vorbereitung des Methodentransfers muss das TL dem RL die betreffenden Informationen zur Verfügung stellen. Das so genannte "Transferpaket" umfasst meist folgendes:
- analytische Daten
- frühere Methodenvalidierungsberichte
- frühere Transferberichte
- relevante Standardarbeitsanweisungen (SOPs)
- Beispiel Chromatogramme
- Trends der Qualitätskontrolle (QC)/Stabilitätsdaten
- Ggf. eine Liste früher aufgetretener Probleme und wie diese behoben wurden.
Hierfür wird ein Methodentransferprotokoll (MTP) erstellt, das von beiden Parteien (TL und RL) unterzeichnet wird und mindestens folgendes umfasst:
- Ziele des Methodentransfers
- Umfang und Verantwortlichkeiten des TL und des RL
- Methodenspezifikationen
- Versuchsaufbau und Akzeptanzkriterien
- Dokumentation (einschließlich der mit den Ergebnissen zu liefernden Informationen und ggf. zu verwendenden Berichtsformulare)
- Referenzen
- Genehmigung des Berichts
- Einzelheiten zu Referenzproben (Ausgangsmaterialien, Zwischenprodukte und Endprodukte).
Das RL überprüft den MTP und stellt fachkundiges - sowie nach Möglichkeit erfahrenes Personal für die Durchführung des Transferprozesses zur Verfügung. Der Arbeitsablauf zwischen den Parteien ist in Abbildung 1 beschrieben.
Sollten die Akzeptanzkriterien nicht erfüllt werden (Abbildung 1), so müssen die im MTP beschriebenen Methoden vollständig überprüft werden um deren Validierung sicherzustellen.
Abbildung 1. Der Arbeitsablauf zwischen TL und RL
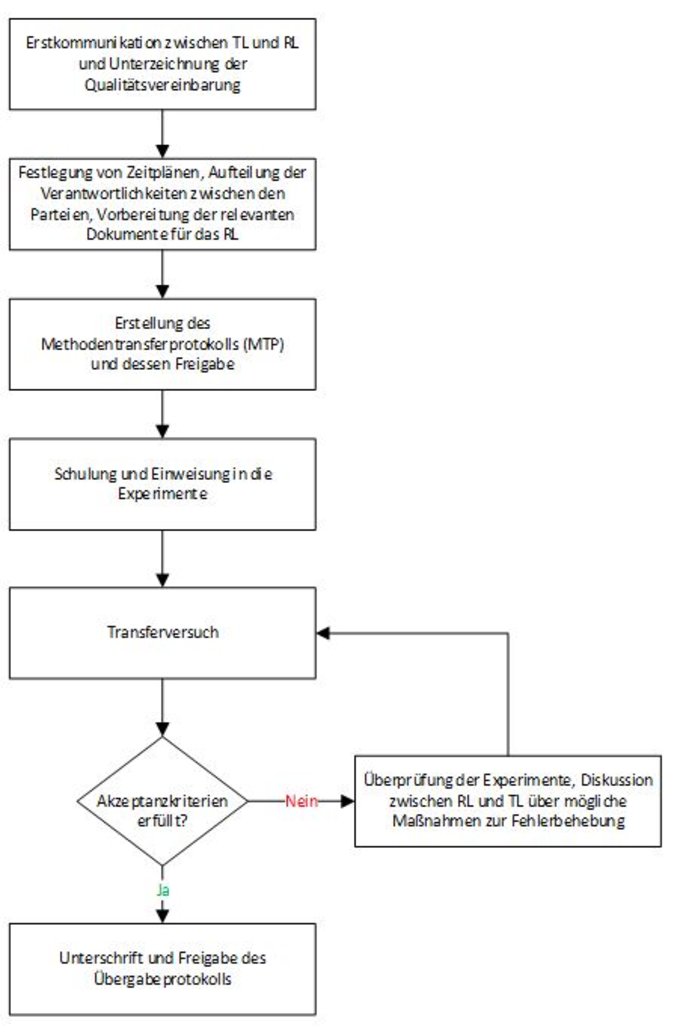
Zusätzliche zu überprüfende Aspekte
- Wird die Validierung durch das TL gemäß den aktuellen ICH-Richtlinien durchgeführt?
- Deckt das Validierungsdesign die beabsichtigte Verwendung der Methode ab (z. B. Freigabe/Stabilität/Prozessprüfung etc.)?
- Erfüllen die vom übergebenden Laboratorium erzielten Ergebnisse die Akzeptanzkriterien?
Neben den methodischen Aspekten ist zusätzlich sicherzustellen, dass alle benötigten Geräte, Chemikalien sowie ggf. weitere spezifizierte Verbrauchsmaterialien innerhalb des RLs während dem definierten Durchführungszeitraums des Methodentransfers zur Verfügung stehen.
Akzeptanzkriterien für einen erfolgreichen Methodentransfer:
Akzeptanzkriterien sind kritische Komponenten des analytischen Methodentransfers und müssen dementsprechend konkret definiert werden.
Zur Festlegung von Akzeptanzkriterien für den Transfer können unterschiedliche Ansätze verwendet werden - z. B. die Anpassung von Akzeptanzkriterien für die Validierung, die Kenntnis des Prozessfähigkeitsindex (Cpk) oder die Anwendung eines statistischen Ansatzes nach Festlegung eines akzeptablen Produktrisikos.
Für weniger komplexe Methoden ist ein direkter Vergleich der Ergebnisse möglich, während bei komplexen Anwendungen statistische Äquivalenztests anzuwenden sind.
Es gibt prinzipiell drei Möglichkeiten, die Akzeptanzkriterien für Methodentransfers zu definieren: absolute Grenzen für Unterschiede und Variabilität, statistische Signifikanztests (t-Tests), statistische Äquivalenztests.
Methodentransfer-Strategien:
Bei der Festlegung der anzuwendenden Transferstrategie sollte eine Bewertung im Hinblick auf (1) die Art der Methode, (2) ihren validierten Status, (3) das beabsichtigte Produkt und (4) die Erfahrung des empfangenden Labors durchgeführt werden. Je nach Ergebnis dieser Bewertungen kann die Vorgehensweise beim Methodentransfer variieren. Auch die spezifische Anwendung der Methode (z. B. Freisetzung, Stabilität, In-Process usw.) muss vollständig berücksichtigt werden.
Die Art der Methode, der Versuchsaufbau und die Datenanalyse müssen auf die jeweilige Situation zugeschnitten sein, damit die Erwartungen der Behörden erfüllt werden können. Ein Methodentransfer kann stark vereinfacht werden, wenn z. B. das Receiving Laboratory bereits Erfahrung in der Durchführung einer ähnlichen Methode, verschiedener Stärken oder Darreichungsformen desselben Produkts hat.
Im Folgenden (Tabelle 1) werden die verschiedenen Arten von Methodentransferkategorien auf der Grundlage von USP 1224 beschrieben:
Tabelle 1: Verschiedene Arten des Methode-Transfer Strategie mit Beispiele:
Schluss / Zusammenfassung:
Methodenvalidierung und -transfer sind integrierte Aktivitäten des analytischen Lebenszyklusmanagements. Die Ergebnisse des Methodentransfers sollten den Validierungsstatus einer analytischen Methode in einem anderen Labor als dem Validierungslabor bestätigen. Um die Methodenkonsistenz zwischen zwei Standorten zu gewährleisten, sollte ein Transferansatz und -design die technischen Risiken berücksichtigen. Insgesamt erfordert ein erfolgreicher Transfer den Austausch von Informationen, Kommunikation und Koordination zwischen TL und RL.
Quellen
1 USP <1224> Transfer of Analytical Procedures. USP–NF. US Pharmacopeial Convention: Rockville, MD.
2 Guidance for Industry: Analytical Procedures and Methods Validation for Drugs and Biologics. US Food and Drug Administration: Silver Spring, MD, 2015.
3 ICH Q2(1): Validation of Analytical Procedures. The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use: Geneva, Switzerland, 1994.
Diese Seite verwendet Cookies, um Ihnen das bestmögliche Erlebnis zu gewährleisten. Surfen Sie weiterhin auf unserer Seite, stimmen Sie unserer Cookie-Nutzung und unserer Datenschutzrichtlinie zu.